目录
在使用收益法进行企业评价时,需要透过营业收人进行自由现金流量的估计。从药厂角度,管业收入由药物价格及药物销售量决定,而药物牵涉医疗活动、人民生活福祉,价格须取得经济与社会两者间的平衡,本文简要汇整国内外文欢,介绍且前主要的药物定价方法,供读者了解。
药物市场基本上依循市场经济,产品价格由供给和需求双方决定。因此大多数的药物定价模型,会反应产品特性、市场竞争、以及病患需求三个重要影响因子。WHO(2018)针对癌症药物的订价进行详细的探讨,将药物定价的角度分为国家政策、产业、以及付费者者三个面向,国家角政策度考虑人民健康目标 (health system-related goal)及 经济目标 (economic goal),例如希望药物价格为病患可以负担,或者是提升本土制药业的竞争力等 (详如表一)。
产业面的定价角度则著重于药物研发成本的回收、以及企业的获利,因此在计算上露要针对不同药物的产业键分工、过去研发成本、生产成本、市场结构等面向进行估计。
最后是付费者的定价角度,在医药产业中,所谓付费者除包含一般消费者外,也包含政府主管机关、医院、金融保险业者、第三方药物管理机构(third-party administrator) 等机构,在药物定价以成本 (cost based) 或价值 (valuebased)作为基碰,成本基础与产业面的定价类似,指的是取得药物或医疗服务,所需要的投入,也就是需要有完整的药物成本资讯 (包含人工、研发、制造等),因为上述资讯取得困难,使得成本基础定价在国际上较少被使用。
价值基础定价顾名恩义为根据药物对于病患或医疗系统的贡献,决定药物应该有的合理价格。因为价值与价格互相连结,从学理上此方法可鼓励药厂投入研发更好的产品,对于付费者来说,也愿意以更高的价格取得更好的产品或服务。因具有上述优点,许多国家已经开始使用此方法进行药物的定价!,惟所谓的药物价值需要透过多面向的评估,搜集多种参数决定,在实际操作上相对困难。
除上述两种方法以外,另外也有参考定价、药价协商、获利控制、药品给付协议 (Managed Entry Agreement, MEA)、效果基础 MEA 等其他方法,因药物定价牵涉层面广泛复杂,且定价方法众多,以下仅针对评价过程中较常会使用到的产业面定价、参考定价及价值基础等进行讨论 (详如表二)。
表一、癌症药物定价方法
| 角度 | 方法/措施 |
| 国家政策 | 医疗目标:病患取得药物的可负担性、时效性、提升医疗能力及透明度 |
| 经济目标:药物价格永续性、管理效率、研发创新、本土制药业发展及竞争力 | |
| 产业 | 产业价值链投入: 制药业者基于企业本身的开发成本与获利考量、以及上中下游生产报价,设定价格,一般会考虑过去研发成本、生产成本、财务目标、研发投资报酬。 |
| 市场结构分析:评估市场利基,例如发病率、药物制程复杂会需要较高的成本、产品适用的法规、专利、竞争与垄断 |
表二、药物定价模型(付费者角度)
| 方法 | 简介 | 例子 |
| 财务风险合约financial risk-based contracts | 在合约中设定特定的财务成果,同样疗效但成本较低,未达到可全额或部分退款 | AstraZeneca所推出之抗血栓用药百无凝(Brilinta) |
| 健康效果合约health outcomes contracts | 类似财务风险合约,在病人使用后无效的情况下,提供购买者全额或部分退款,类似无效退费 | 慢性病例如多发性硬化症(multiple sclerosis), 糖尿病(diabetes)、慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD) |
| 抵押模式mortgage models | 对于成本较高昂的疗法,提供购买者在一定时间内分期支付药物成本。 | Spark Therapeutics所开发的Luxturna基因疗法 |
| 订阅模式subscription or Netflix models | 提供购买者以一定金额在一定时间内,无限制让病人使用特定产品。 | 澳洲、美国C肝治疗 |
| 特定适应症定价Indication specific pricing | 当药物被核可用于多种疾病时,针对特定疾病以治疗效果进行差异化定价。 | 美国第三方药品福利管理业者Express Scripts、CVS针对癌症及自体免疫产品定价 |
| 大量采购volume-based purchasing | 适用在持续需要大量使用产品,例如预防性的流感疫苗、学名药、抗生素的采购 | 美国麻疹腮腺炎德国麻疹混合疫苗(Measles, Mumps and Rubella; MMR)一剂仅20美元。 |
承上述 WHO 报告,参考定价为挑选指标案例进行比较,指标案例可以是相同药物在不同国家的假格。此参考饼格又称为外部参考价格(extemalreference pricing, ERP)或国际参考价格 (international reference pricing),若是以相似成分、功效、剂型的药物价格做为参考,则称为内部参考价格 (intermal reference pricing, IRP) 。
此定价方法相对于成本基础及价值基础方法,较不需要庞大的资料需求就可进行,在实务操作上大部分是产业专家针对指标药物价格进行调查、资料搜集分析等工作。国际参考价格经常使用平均每人 GDP 作为参考指标,后续挑选 GDP 相似国家的药价作为参考价格,基本上使用人均 GDP 作为参考指标是一个好的方式,且人均 GDP 和人均医疗支出(health expenditure per capita)通常具有正向关系,这也反应所得高的国家,较有能力负担较高的药物价格。
图三为从 IVF 资料库取得之各国 2019年人均 GDP,以及世界银行资料库之 2019 年人均医疗支出,以平均值挑选入均 GDP 前 50%的国家后,以人均 GDP 及人均医疗支出作为横轴及纵轴,可以清楚看到美国、北美、瑞士,这三个国家人均医疗支出较其他人均 GDP 类似的国家高,而卢森堡、爱尔兰、新加坡、卡达等国家则是人均医疗支出较其他人均 GDP 类似的国家低,显示这些国家的药物价格,并不一定适合直接作为参考价格。
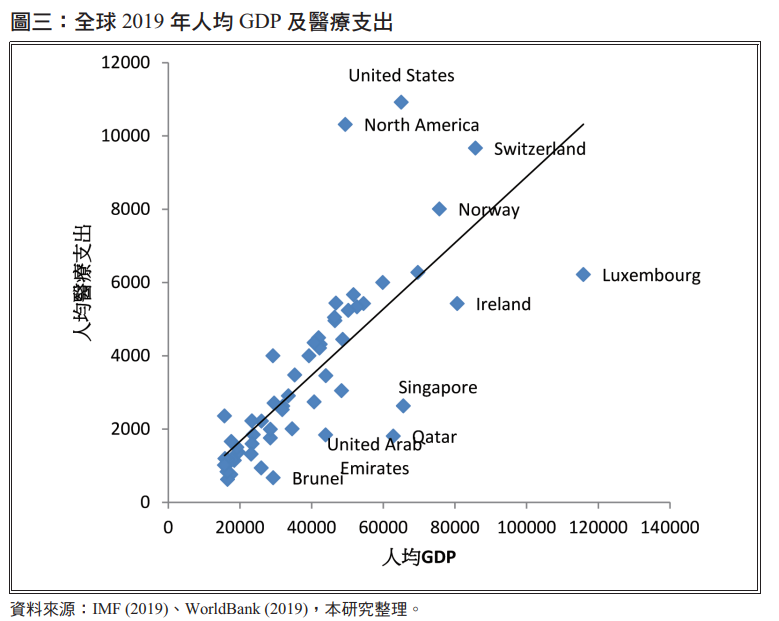
从上述数据可看出美国的医疗支出为所有国家中最高者,又因为美国医疗体系成熟、市场庞大且活跃,使得美国药价成为研究机构及学者探讨的议题之一,以美国众议院的监管和政府改革委员会(2021)针对AbbVie所销售的复迈 (Humira) 及亿珂 (Imbruvica) 两款畅销药进行国际价格分析为例,2018年美国 Humira(40 mg) 价格为1,727美元,而其他如德国、英国、比利时、罗马尼亚等欧洲国家相同产品价格大约在508-965美元,日本及韩国售价则仅有503及424美元,美国药物价格整整高出其他国家3-4倍以上;Imbruvica (140 mg) 美国药价大概135美元,欧洲国家的药物价格则大约落在63-97美元。
从上述两个案例可以发现美国药价高出其他国家许多,Mulcahy 等人(2021)针对美国、G7国家、OECD国家的销售前60大活性成分(含原开发厂药、学名药、生物药等)的药价进行总体比较,该研究结果指出,在药物价格没有经过GDP调整的情况下,销售额前60大药物平均药价,美国价格高于其他OECD国家395%,为差异最大者;非品牌之学名药差异较小,美国价格高于其他OECD国家84%,为差距幅度最小者,其他请详表四。
表四、美国药价与其他G7国家、OECD 32国比较
| 药物分组 | G7 | OECD-32 | |||||
| Canada | France | Germany | Italy | Japan | United Kingdom | ||
| 具商品名原开发厂药 Brand-name originator drugs | 294 | 349 | 280 | 315 | 307 | 349 | 344 |
| 销售额前60大药 Top 60 drugs by sales | 329 | 425 | 325 | 367 | 363 | 414 | 395 |
| 无品牌学名药 Unbranded generics | 57 | 58 | 62 | 59 | 43 | 68 | 84 |
| 所有非原开发厂药 All non-originators | 83 | 91 | 95 | 104 | 72 | 102 | 121 |
| 生物药 Biologics | 254 | 316 | 245 | 290 | 304 | 325 | 295 |
| 非生物药 Non-biologics | 198 | 221 | 211 | 215 | 160 | 220 | 234 |
| 全部药品 All Drug | 218 | 258 | 225 | 244 | 209 | 255 | 256 |
注:上述数值为药物价格指数(美国比其他国家药价比例),参考消费者物价指数(CPI)的计算方式,以药物在美国之销售价×销售量市场占比,计算加权平均药价,在比较其他国家如加拿大时,以加拿大的药物价格×美国销售量得到加权平均药价,以利比较美国和其他国家药价差异。
Mulcahy 等人(2021)的研究因为是直接分析药物市场价格,评价人员在具有美国药物价格的情况下,可以简单计算其他国家的可能定价,有助于估计药物在各地区之营收估计。
产业面定价是以药厂或生技公司的角度针对药物价格进行估计,以商业利益作为出发点,因此会考量以下5个重点。
以可以回收过去所有研发成本作为药物定价的前提,甚至有些业者认为资金成本及机会成本也应纳入计算,药物的研发成本会受到药物种类、适应症、临床试验人数、风险等许多因子影响,因此通常需要个别估计。
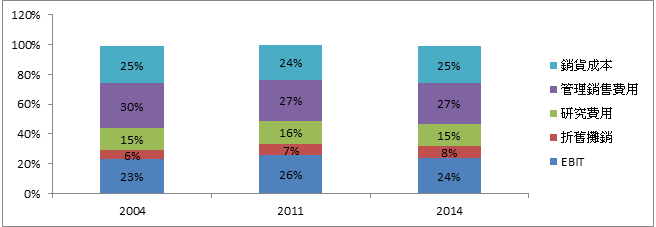
为药物商品化的必须支出,例如法律相关规费、制造、物流、管理销售等成本费用,根据Gyurjyan et al., (2016)的研究,2004年至2014年之制药产业销货成本大约占营收之24~25%,而管销费用则大约占27~30%之间。
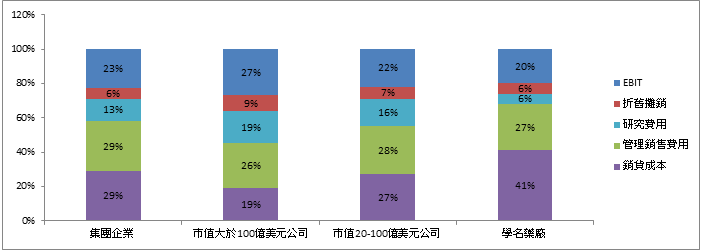
而上述研究进一步以企业规模做为分类,分析不同规模的制药业者成本费用占比差异,发现市值大于100亿美元的公司之生产成本仅占营收的19%,可以有近27%的税前息前营业净利(EBIT),而市值在20-100亿美元间的药厂,生产成本则提高至27%,EBIT则仅剩22%,在管理销售等营业费用,则与企业规模大小较无关,范围介于占营收之25-31%。显示企业规模
也就是前述所提及之价值基础定价,因为需要分析药物疗效、该地区罹病人数、国家预算、使用状况等多方面的科学数据与资料,计算困难。
药厂根据企业本身的财务目标,订定相对应的药物售价,例如癌症标靶药物Bevacizumab、Trastuzuma在2012-2014年年间涨了7-8%,但该期间药物生产成本及药物的医疗价值并没有明显变动。
业者主张药物价格需要有足够的诱因,才可鼓励企业继续投入新药物的研发。以投资角度来说,企业需要有合理的投资报酬,才会进行下一次的投资。Kiu等人(2019)观察1989-2017年FDA核可的99个癌症药物的投资报酬,在风险调整研发成本为7.9亿美元的情况下,每投入1美元的研发支出,会贡献14.5美元的营业额(中位数)。若以投资还本期角度来看,投资还本期中位数为药品上市后的第3年。
上述重点大多为企业对于成本及获利的估计,有许多研究文献深入探讨此一主题,本文属常见方法的介绍,因此研发成本及CMC成本的估计另文探讨。
价值基础定价是根据药物的疗效决定药物价格,药物经济学(pharmacoeconomics)经常使用成本效果分析(cost-effective analysis, CEA)、成本效益分析(cost-benefit analysis, CBA)、成本效用分析(cost-utility analysis, CUA)等工具评估医疗科技的价值,而价值基础定价经常依照上述评估工具,以递增成本效果比值(incremental cost-effectiveness ratio, ICER)进行药品定价。
根据Parmar et al., (2019)的文章,所谓ICER指的为ΔC/ΔE,ΔC为新药物治疗所需成本与对照药物治疗成本的差额,ΔE则为上述两者间的疗效差异,最简单的方式为以对照药物的比值,换算为新药物的治疗成本,就可计算出药物应该具有的价格。其中,因为价值基础角度以使用者为出发点,ΔC通常会以疗程(treatment)价格或年花费(annual cost)作为代表;ΔE则会以自然单位(natural units)代表,例如可增加的存活年、血压、血糖等生理生化值。
对于药物经济学,疗效的提升意味著存活年数(life year, LY)及生活品质调整后的存活年数(quality adjusted life year, QALY,又称健康人年)增加,若再配合上述花费单位进行CEA计算,则形成所谓的每单位价格/品质调整后存活年数($/QALY),以存活年数或品质调整后存活年数为单位,可将不同作用机制的药物以相同的单位进行比较。
举例来说美国临床及经济审查机构(Institute for Clinical and Economic Review, ICER)在2019年针对Upadacitinib以价值基础方法估算,考量在同样成本下,Upadacitinib搭配cDMARD6合并治疗的品质调整存活年数较Adalimumab7搭配 cDMARD合并治疗高、且具有可口服优点,相较Adalimumab多了$92,000/QALY,但因为实际存活年数与Adalimumab相比并未有明显增加,因此估算药价为一年44,000-45,000美元,比起原公司所列药价59,860美元/年折价25-26%。
价值基础定价核心为经济面的医疗科技评估,在理论上相较其他方法最符合逻辑,因需要同时评估疗效与经济效益,且需要取得药厂及主管机关的临床试验资料,因此在世界各国大多由专门的权责单位或权威机构负责,例如英国国家健康与照顾卓越研究院(The National Institute for Health and Care Excellence, NICE)、美国临床及经济审查机构(Institute for Clinical and Economic Review, ICER)等,上述单位除针对特定药物或主题进行定价分析以外,也会针对评估方法做较详细的说明,有兴趣的读者可至上述机构网站深入了解。
药物定价过程复杂,通常由专业机构或主管机关进行评估分析,而在评估新药开发公司之价值,往往需要计算未来产品上市后之现金流量,因此判断委任方所提之销售计划及药价估计是否合理相当重要。
本文分别介绍以企业角度及付费者角度的药物定价方法,读者在执行企业/无形资产评价时,可以留意以下重点,做适度的药价估计/调整:
药价估计难以做到精准,距离上市时间越长越难估计,容易受到竞争药品研发进展所影响,且实际药物定价通常会采用多个方法进行计算,并经过与政府、保险机构、病患等多方利害关系人谈判沟通,才会决定最终的药价,在取得资源有限的情况下,使用可类比药物的参考定价是一个比较可行的做法。

电子报订阅